近日,来自云顶集团yd1233公共卫生学院王福俤团队联合医学院/转化医学研究院闵军霞团队及广东省微生物研究所谢黎炜团队在国际著名学术期刊Advanced Science(影响因子15.804)发表题为“Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes”的研究论文[1]。揭示转铁蛋白受体(Transferrin Receptor 1, Tfr1)通过特异机制调控棕色/米色脂肪细胞功能和发育。在米色脂肪形成过程中,活化的缺氧诱导因子HIF1α通过转录调控Tfr1表达促进铁吸收从而维持线粒体功能;在棕色脂肪发育过程中,Tfr1以非铁依赖的方式调控棕色脂肪与白色脂肪、肌细胞的转分化。

脂肪组织是参与调控全身能量代谢的重要器官,主要由三种脂肪细胞构成:白色、棕色和米色。白色脂肪用于贮存能量,而棕色脂肪用于消耗能量,通过非战栗性产热来维持体温恒定。活化棕色脂肪有助于机体抵抗能量摄入过多引起的脂肪堆积,从而抑制肥胖的发生[2]。米色脂肪是近年来新发现可以被冷刺激或β3-肾上腺素受体激动剂诱导形成的一种产热脂肪,在治疗肥胖及相关代谢性疾病方面有极好的应用前景[3]。通过深入了解白色脂肪米色样变及棕色脂肪形成和活化的分子调控机制,对于靶向干预促进棕色/米色脂肪产热具有重要的理论和实践意义。
微量元素铁在维持营养和能量代谢平衡中扮演重要角色[4]。脂肪细胞铁稳态代谢的研究多集中在白色脂肪。在白色脂肪细胞分化过程中,通过DFO螯合细胞中铁离子或者敲降转铁蛋白(Tf)可以显著抑制脂合成[5];添加铁和Tf可以促进脂肪细胞脂解[6],抑制胰岛素刺激的葡萄糖吸收[7]。遗传性低铁模型Tmprss6敲除小鼠脂肪组织铁含量减少,白色脂肪脂解增加,从而抵抗高脂膳食诱导的肥胖[8]。然而铁稳态代谢对棕色脂肪细胞分化产热以及白色脂肪米色化的调控作用及其分子机制尚待深入研究。
研究人员在β3肾上腺素激动剂CL-316,243诱导米色脂肪形成的小鼠模型上,通过H3K9/14Ac ChIP-seq、RNA-seq和iTRAQ膜蛋白质组等多种组学技术发现铁稳态代谢被明显富集,并筛选出转铁蛋白受体Tfr1表达显著上调。随后发现Tfr1脂肪特异性敲除(Tfr1Adp/Adp)小鼠对冷不耐受,冷诱导的米色脂肪细胞形成被抑制,冷诱导的棕色脂肪产热和脂解减少,线粒体形态和铁稳态代谢异常(图一)。在高脂膳食(HFD)诱导的肥胖模型下,Tfr1敲除虽然不影响食欲和体重,但是可加剧HFD诱导的脂代谢紊乱、胰岛素抵抗和脂肪组织炎症。
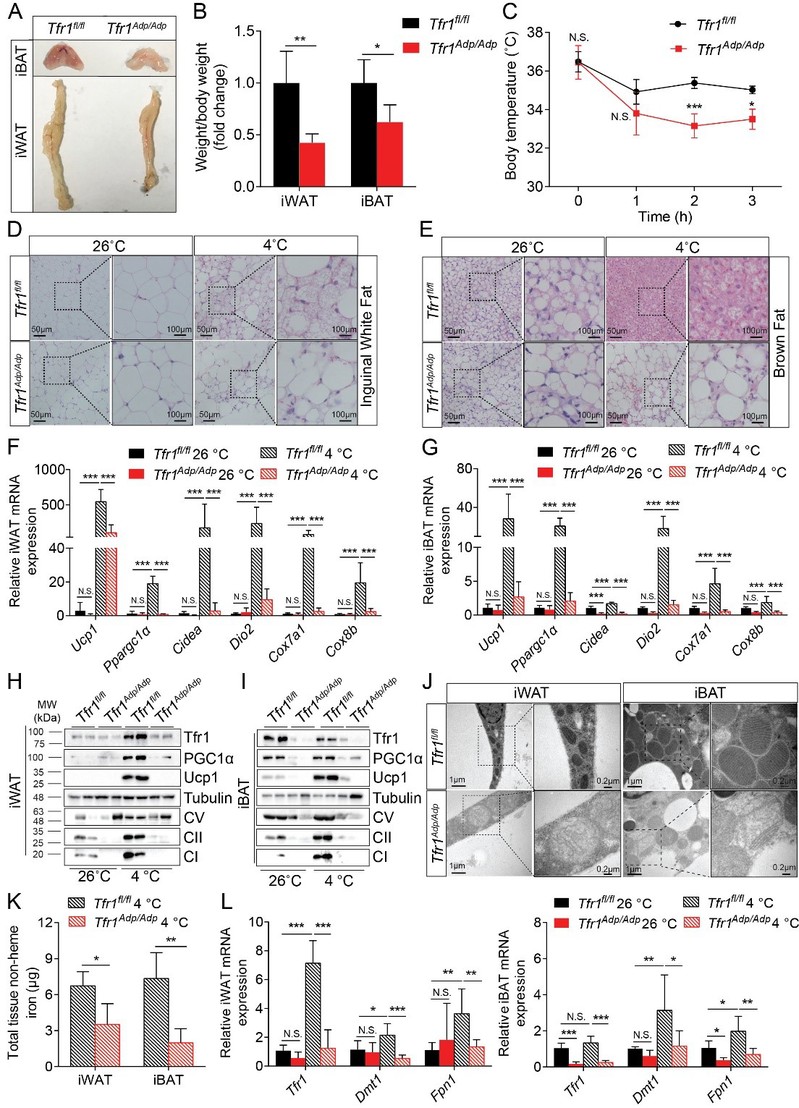
图一:Tfr1脂肪特异性敲除小鼠棕色/米色脂肪功能异常
(选自Li et al. Advanced Scicence, 2020)
随后,研究人员对米色脂肪形成过程中Tfr1表达上调的分子机制进行了研究,发现缺氧诱导因子HIF1α蛋白表达和入核活化明显增加,棕色脂肪特异性敲除Hif1α (Hif1Ucp1/Ucp1)小鼠表现出冷诱导的米色脂肪生成被抑制,而棕色脂肪却未见明显改变。通过Chip-qPCR实验发现冷刺激可以诱导米色脂肪HIF1α与Tfr1启动子结合促进其转录。以上结果提示冷刺激诱导HIF1α活化,通过转录调控Tfr1表达控制铁吸收从而促进白色脂肪米色化。
为了解析Tfr1敲除导致棕色脂肪功能异常的机制,研究人员通过转录组分析发现Tfr1敲除可以明显增加干细胞、白色脂肪细胞和肌细胞标志基因表达,并对这些基因表达进行验证。从而表明Tfr1在棕色脂肪细胞命运决定中扮演重要角色。然而这一作用与Tfr1敲除造成的低铁状态无关,因为无论是遗传性低铁(Tmprss6-/-)小鼠模型还是孕期低铁饲喂均不能模拟Tfr1敲除引起的棕色脂肪细胞向肌细胞转分化,表明Tfr1可能通过非铁依赖的作用调控棕色脂肪细胞分化。然而Tmprss6-/-小鼠冷诱导的米色脂肪生成被抑制,表明铁稳态在白色脂肪米色化过程中起重要作用。Tfr1如何通过铁依赖与非铁依赖作用调控棕色/米色脂肪细胞产热和分化仍待进一步研究。
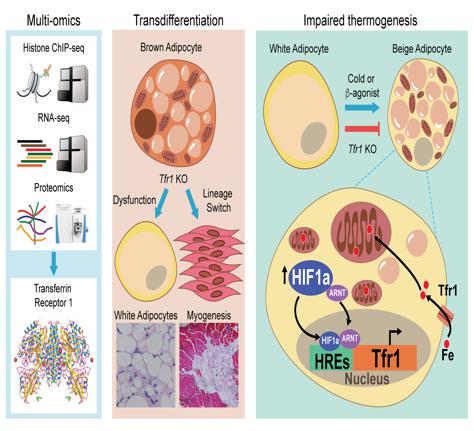
图二:Tfr1调控棕色/米色脂肪细胞产热和分化的模式图
(选自Li et al. Advanced Scicence, 2020)
该原创成果发现Tfr1和铁稳态代谢在调控棕色和米色脂肪细胞产热和命运决定中的关键作用,揭示了冷刺激诱导活化的HIF1α通过转录调控Tfr1促进白色脂肪米色化。该重大成果为脂肪细胞命运调控及机体铁稳态代谢提供新的认识,为肥胖及相关代谢性疾病靶向治疗提供了新思路。
云顶集团yd1233医学院李瑾博士后为本文的第一作者;王福俤教授、闵军霞教授及谢黎炜研究员为共同通讯作者;云顶集团yd1233医学院为第一作者及通讯作者单位。该项目得到国家自然科学基金委及国家科技部项目资助。
参考文献:
1.Li J#, Pan X#, Pan G, Song Z, He Y, Zhang S, Ye X, Yang X, Xie E, Wang X, Mai X, Yin X, Tang B, Shu X, Chen P, Dai X, Tian Y, Yao L, Han M, Xue G, Zhong H, Sun J, Chen H, Wang F*, Min J*, Xie L*. Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes.Advanced Science 2020.
全文链接:https://doi.org/10.1002/advs.201903366
2.Lowell BB, V SS, Hamann A, Lawitts JA, Himms-Hagen J, Boyer BB, Kozak LP, Flier JS. Development of obesity in transgenic mice after genetic ablation of brown adipose tissue. Nature 1993, 366(6457): 740-742.
3.Wu J, Bostrom P, Sparks LM, Ye L, Choi JH, Giang AH, Khandekar M, Virtanen KA, Nuutila P, Schaart G, Huang K, Tu H, van Marken Lichtenbelt WD, Hoeks J, Enerback S, Schrauwen P, Spiegelman BM. Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell 2012, 150(2): 366-376.
4. 王佳明, 安鹏, 王浩, 吴谦, 方学贤, 闵军霞, 王福俤. 铁稳态代谢分子机制及铁磁纳米颗粒研究进展. 科学通报, 2018, 63, Doi:10.1360/N972018-00707
5.Moreno-Navarrete JM, Ortega F, Moreno M, Ricart W, Fernandez-Real JM. Fine-tuned iron availability is essential to achieve optimal adipocyte differentiation and mitochondrial biogenesis. Diabetologia 2014, 57(9): 1957-1967.
6.Rumberger JM, Peters T, Jr., Burrington C, Green A. Transferrin and iron contribute to the lipolytic effect of serum in isolated adipocytes. Diabetes 2004, 53(10): 2535-2541.
7.Green A, Basile R, Rumberger JM. Transferrin and iron induce insulin resistance of glucose transport in adipocytes. Metabolism: clinical and experimental 2006, 55(8): 1042-1045.
8.Folgueras AR, Freitas-Rodriguez S, Ramsay AJ, Garabaya C, Rodriguez F, Velasco G, Lopez-Otin C. Matriptase-2 deficiency protects from obesity by modulating iron homeostasis. Nature communications 2018, 9(1): 1350.
(稿件来源:王福俤教授团队)


